| 1.水
|
|
水是地球上数量最多的化合物之一,与人们的生活、动植物生长、工农业生产密切相关。由于水的结构在不同温度、压力下都有变化,几个世纪前人们就开始研究水的结构,这种研究一直持续至今日。
气态单个水分子的结构已确定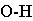 键长95.7pm,∠HOH为 键长95.7pm,∠HOH为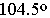 在冰、水或水合物晶体中,H2O分子均可看作按四面体方向分布的电荷体系。水分子的两个氢原子指向四面体的两个顶点,显正电性。而氧原子上的两个孤对电子指向四面体另外的两个顶点,显负电性。正电性一端常和另一水分子的负电性一端或其它负离子结合,形成 在冰、水或水合物晶体中,H2O分子均可看作按四面体方向分布的电荷体系。水分子的两个氢原子指向四面体的两个顶点,显正电性。而氧原子上的两个孤对电子指向四面体另外的两个顶点,显负电性。正电性一端常和另一水分子的负电性一端或其它负离子结合,形成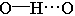 , , 或 或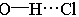 型氢键;负电性的一端常和正离子或其它分子的正电性一端结合,形成 型氢键;负电性的一端常和正离子或其它分子的正电性一端结合,形成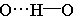 , ,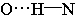 等型式的氢键。 等型式的氢键。 |
|
常压下,水冷至0℃以下即可形成六方晶系的冰-Ih,生活中常见的冰、雪、霜都属于这种结构。0°C时,冰的六方晶系参数为:a=452.27pm,c=736.71pm。晶胞中包含4个水分子,空间群为P61/mmc,密度为0.9168g·cm-3。在冰的晶体中,氢原子核为无序分布,氢原子与近端氧原子的平均距离为97pm,与远端氧相距约为179pm。在真空中,控制温度在133~153k,可从水蒸气直接结晶成立方晶系的冰Ic,Ic晶体中氧原子排列和金刚石相似,而氢原子也是无序排列。 |
|
(a)H2OPhase |
(b)IceItop |
|
(c)Ice2CCP |
|
| (d)IceIc |
|
| (e)IcePhase |
|
(f)IceV |
|
(g)IceVI |
|
(h)IceVII |
图(a)(b)(c)(d)(e)(f)(g)(h)冰的各种晶型结构 |
冰在加压条件下,还可转变成一列不同晶型II~IX,其中VIII与IX为低温时的晶型。各种高压晶型的冰,其密度都比冰I高(Ⅱ
1.17,Ⅲ 1.16,Ⅳ 1.29,V 1.23,VI 1.31,Ⅶ1.65,IX1.16g·cm-3)。其原因不是高压下氢键O-H…O缩短所致,而是O原子配位数增加,出现O和O的非键配位,使其密度增大。 |
|
液态水的结构也有多种变化,至今仍是研究热点,国际上有人用分子动力学模拟液态水的结构。 |
| 2.醇与羧酸
|
| 在结晶醇中,分子通常用折链状氢键联合成聚合体。 |
| |
|
甲醇晶体就具有这种链状结构,氢键长度为266pm。晶体熔化时形成链状或环状联合体,一般氢键未破坏。从液态变为气态,氢键受到破坏,气化热与沸点均明显升高。有人发现甲醇蒸气中有四聚体存在,它的结构可能是四个氢键组成的正方形结构:
|
| |
|
季戊四醇形成四方晶体,氢键键长269pm,把氧原子联结成与甲骨醇四聚体相同的正方形结构。
|
| |
|
图6-16 季戊四醇C(CH2OH)4结构
|
|
大圆圈表示氧原子,中等圆圈表示碳原子小圆圈表示与碳原子联结的氢原子,双线表示氢键 |
|
许多羧酸由于氢键可产生二聚体,例如乙酸二聚体中氧氢键长度为107.5pm,比冰中101pm大得多,这是由于氢键强度增加所致。
|
|
氢键对晶体物理性质的影响在草酸中表现很突出。草酸有两种无水晶型。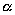 型形成氢键结合的分子层,因此很容易解离,一层层剥开。 型形成氢键结合的分子层,因此很容易解离,一层层剥开。
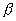 型晶体含有长分子链结构, 两种晶型中氢键长度约为265pm。二者的结构如图所示。
型晶体含有长分子链结构, 两种晶型中氢键长度约为265pm。二者的结构如图所示。
|
| |
图6-17 草酸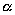 型晶体的层状结构 型晶体的层状结构
|
| |
图6-18 草酸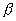 型晶体的链结构 型晶体的链结构
|
|
其它的羧酸都有类似结构,如丁二酸COOH(CH2)2COOH,戊二酸COOH(CH2)3COOH,己二酸COOH(CH2)4COOH等。
|
| 3.核酸中的氢键
|
|
核酸构成遗传的基因,同时控制着蛋白质的制造和有机体细胞的机能。去氧核糖核酸结构中,氢键起着重要的作用。这个结构包含形成一个双螺旋体的两个相互交织的多核甙酸链的细致互补结构,链上的每一对核甙酸分子来说,一个链上的嘧啶根与另一个链上的嘌呤根之间有氢键生成。
|
|
在去氧核糖核酸中发现的嘧啶是胸腺嘧啶和胞嘧啶;其中的嘌呤是腺嘌呤和鸟嘌呤。 |
| |
| 图 6-19
腺嘌呤和胸腺嘧啶生成由两个氢键联结的互补对的示意图 |
| |
| 图 6-20
胞嘧啶和鸟嘌呤生成三个氢键联结的互补对的示意图 |
|