习题4
4.1 根据极值条件: 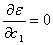 ,
, 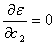 以及
以及 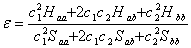 导出
导出
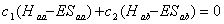
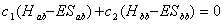
4.2 写出O2 、O2- 、O22- 的键级、键长长短次序及磁性。
4.3 按分子轨道理论说明Cl2的化学键比Cl2+强还是弱?为什么?
4.4 画出CN-的分子轨道能级示意图,写出基态的电子组态,计算键级及不成对电子数。
4.5 试用分子轨道理论讨论SO分子的电子结构,说明基态时有几个不成对电子?
4.6 下列AB型分子:N2 、NO 、O2 、C2 、F2 、CN、CO哪几个是得电子变为AB-后比原来中性分子能量低,哪几个是失电子变为AB+后比原来中性分子能量低?
4.7 OH分子已在星际空间发现
1)试按分子轨道理论只用氧原子2p轨道和氢原子的1s轨道叠加,写出其电子组态。
2)在哪个分子轨道中有不成对电子?
3)此轨道是由氧和氢的原子轨道叠加形成,还是基本上定域于某个原子上?
4)已知OH的第一电离能为13.2eV、HF为16.05eV,它们的差值几乎和O原子与F原子的第一电离能(15.8eV和18.6eV)的差值相同,为什么?
4.8 用两种分子轨道记号写出O2的分子轨道。
4.9 对于H2+或其它同核双原子分子,采用 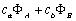 为分子轨道时,且
为分子轨道时,且 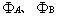 均为1s或2s轨道,仅仅通过变分计算而不求助于对称性原理,你能推出
均为1s或2s轨道,仅仅通过变分计算而不求助于对称性原理,你能推出  吗?
吗?
4.10 以Z轴为键轴,按对称性匹配原则,下列各对原子轨道能否组成分子轨道,若能形成写出分子轨道的类型。
① 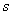 dz2 ②
dz2 ② 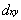
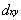 ③
③ 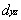
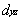 ④
④ 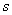
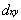
4.11 下列分子可能具有单电子π键的是
① N2+ ② C2- ③ B2+ ④ O2-
4.12 下列分子中,磁矩最大的是
① Li2 ② C2 ③ C2+ ④ B2
4.13 Br2分子的最低空轨道(LUMO)是
① 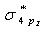 ②
② 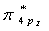 ③
③ 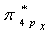 ④
④ 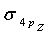
4.14 CO的键长为112.9pm,CO+的键长为111.5pm,试解释其原因。
4.15 试从双原子分子轨道的能级解释:
⑴N2的键能比N2+大,而O2的小。
⑵NO的键能比NO+的小及它们磁性的差别。
4.16 试从MO理论写出双原子分子OF、OF-、OF+的电子构型,求出它们的键级,并解释它们的键长、键能和磁性的变化规律。
4.17 若AB型分子的原子A和B的库仑积分分别为HAA和HBB,且HAA>HBB,并设SAB~0(即忽略去SAB)试证明成键的MO的能级和反键的MO的能级分别为:
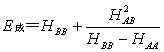
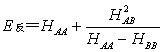
4.18 现有4S,4Px,4Py, 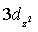 ,
, 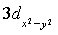 ,
, 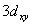 ,
, 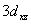 ,
, 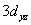 等9个原子轨道,若规定Z轴为键轴方向,则它们之间(包括自身间)可能组成哪些分子轨道?各是何种分子轨道。
等9个原子轨道,若规定Z轴为键轴方向,则它们之间(包括自身间)可能组成哪些分子轨道?各是何种分子轨道。
4.19 请写出Cl2、O2+和CN-基态时价层的分子轨道表达式,并说明是顺磁性还是反磁性。
4.20 HF分子以何种键结合?写出这种键的完全波函数。
4.21 CF和CF+哪一个的键长短些?
4.22 试写出在价键理论中描述H2运动状态的符合Pauli原理的波函数,并区分单态和三重态。
习题5
5.1 试写出SP3杂化轨道的表达形式。
5.2 从原子轨道 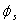 和
和 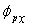 的正交性,证明两个sp杂化轨道相互正交。
的正交性,证明两个sp杂化轨道相互正交。
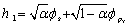
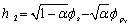
5.3 写出下列分子或离子中,中心原子所采用的杂化轨道:
CS2,NO2+,NO3-,CO32-,BF3,CBr4,PF4+,IF6+
5.4 试求等性d2sp3杂化轨道的波函数形式。
5.5 使用VSEPR模型,对下面给出某些N和P的氢化物和氟化物的键角做出解释
|
NH3 |
107° |
NF3 |
102° |
|
PH3 |
94° |
PF3 |
104° |
5.6 依VSEPR理论预测SCl3+和ICl4-的几何构型,给出每种情况下中心原子的氧化态和杂化方式。
5.7 对下列分子和离子CO2,NO2+,NO2,NO2-,SO2,ClO2,O3等判断它们的形状,指出中性分子的极性,指出每个分子和离子的不成对电子数。
5.8 利用价电子对互斥理论说明AsH3, ClF3, SO3, SO32-,CH3+,CH3-,ICl3等分子和离子的几何形状,说明那些分子有偶极矩。
5.9 对于极性分子AB,如果分子轨道中的一个电子有90%的时间在A的原子轨道 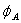 上,10%的时间在B的原子轨道
上,10%的时间在B的原子轨道 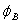 上,试描述该分子轨道波函数的形式(此处不考虑原子轨道的重叠)
上,试描述该分子轨道波函数的形式(此处不考虑原子轨道的重叠)
5.10 用杂化轨道理论讨论下列分子的几何构型:
C2H2,BF3,NF3,C6H6,SO3
5.11 讨论下列分子和离子中的化学键及几何构型:
CO2,H2S,PCl3,CO32-,NO3-,SO42-
5.12 根据Hűckel 近似,写出下列分子π 电子分子轨道久期行列式:
j 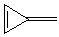 k
k  l
l 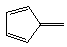 m
m 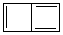
5.13 写出下列各分子的休克尔行列式:
⑴ CH2=CH2 ⑵ 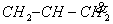 ⑶ C6H6
⑶ C6H6
5.14 用HMO或先定系数法求出戊二烯基阴离子π电子分子轨道的表达形式及其对应的能量。
5.15 用HMO或先定系数法求出C6H6π电子分子轨道的表达形式及其对应的能量。
5.16 比较ROH,C6H5OH,RCOOH的酸性,并说明其理由。
5.17 试比较CO,R-COH,CO2碳氧间键长的大小。
5.18 环己烷——1,4二酮有五种可能构象:椅式,两种船式,两种扭转式(对称性一高一低)。请画出这五种构象,并确定它们所属的点群。
5.19 XeOnFm化合物是稳定的(n,m=1,2,3…),请用VSEPR模型,推导所有具有这一通式的化合物结构。
5.20 大部分五配位化合物采用三角双锥或四方锥结构,请解释:
a) 当中心原子为主族元素时,在三角双锥结构中轴向键比水平键长,而在四方锥中则相反。
b) 当中心原子为过渡金属时,如四方锥[Ni(CN)5]3-中,轴向Ni—C键217pm,水平187pm;而在三角双锥 [CuCl5]3-中,轴向键Cu—Cl 230pm,水平键239pm。
5.21 二硫二氮(S2N2)是聚合金属的先驱,低温X射线分析指出S2N2是平面正方形结构(D2h)假设该结构由S、N作sp2杂化形成σ键,N的2p轨道与S的一个3p、一个3d轨道形成π键。
(1)试描述S4N2可能的成键情况(S4N2为平面结构)
(2)比较S4N2中2个不同S—N键与S2N2中SN键长度。
5.22 试用前线轨道理论说明乙烯在光照的条件下,发生环合反应生成环丁烷的机理。
5.23 试用前线轨道理论说明反应: 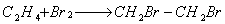 不可能是基元反应。
不可能是基元反应。
5.24 试用轨道对称守恒原理讨论己三烯环合反应对热与光的选择性.
习题6
6.1 写出B2H6和B3H9的styx数, 画出相应的结构图,并指出s, t, y, x字母的含义.
6.2 导出B4H10可能的styx数, 并写出对应的结构图.
6.3 根据式(6-11)求出B5H11, B6H10 可能的异构体数目.
6.4 金属团簇M5(M=Li, Na, K)有21种异构体, 试画出它们的拓扑结构.
6.5 计算下列各团簇的价电子数, 并预测它们的几何构型:
Sn44-, Sn3Bi2, Sn3Bi3+, Sn5Bi4
6.6 试用12个五边形和8个六边形构成C36笼的结构.
6.7 [CO(NH3)6]2+是高自旋络合物,但在空气中易氧化成三价钴络合物[CO(NH3)6]3+,变成低自旋络合物,试用价键理论或晶体场理论来解释,看哪种比较合理。
6.8 Ni2+的低自旋络合物常常是平面正方形四配位的结构,高自旋络合物则都是四面体场结构,试由价键理论或晶体场理论来解释。
6.9 对于电子组态位d4的八面体过渡金属离子配合物,试计算:
⑴分别处在高、低自旋基态时的能量;
⑵当高、低自旋构型具有相同能量时,电子成对能P和晶体场分裂能10Dq的关系。
6.10 配合物[CO(NH3)4Cl2]只有两种异构体,若此络合物为正六边型构型有几种异构体?若为三角柱型时,又有几种异构体?那么到底应是什么构型?
6.11 将C2H6和C2H4通过AgNO3溶液,能否将它们分开?如果能分开,简要说明微观作用机理。
6.12 在八面体配合物中dx2-y2和dxy轨道哪个能量高?试用分子轨道理论说明其原因。
6.13 卤素离子,NH3,CN-配位场强弱次序怎样?试从分子轨道理论说明其原因。
6.14 硅胶干燥剂中常加入COCl2(蓝色),吸水后变为粉红色,试用配位场理论解释其原因。
6.15 尖晶石的化学组成可表示为AB2O4,氧离子紧密堆积构成四面体孔隙和八面体孔隙,当金属离子A占据四面体孔隙时,称为正常的尖晶石;而A占据八面体孔隙时,称为反式尖晶石,试从配位场稳定化能计算结果说明NiAl2O4是何种尖晶石结构。
6.16 试画出三方柱型配合物MA4B2的全部几何异构体。
6.17 判断下列络离子是高自旋还是低自旋,画出d电子的排布方式,说明络离子的磁性,计算晶体稳定化能。
Mn(H2O)62+,Fe(CN)64-,CO(NH3)63+,FeF63-
6.18 作图示出[PtCl3(C2H4)]+离子中Pt2+和C2H4间的化学键的轨道叠加情况并回答:
⑴Pt2+和C2H4间化学键对C-C键强度的影响。
⑵[PtCl3(C2H4)]-是否符合18电子规律?解释其原因。
6.19 解释为什么大多数Zn2+的络合物都是无色的?
6.20 试画出N2和CO与过渡金属配合物的成键轨道图形。
6.21 作图给出下列每种配位离子可能出现的异构体
⑴[Co(en)2Cl2] +
⑵[Co(en)2(NH3)Cl] 2+
⑶[Co(en)(NH3)2Cl2] +
6.22 许多Cu2+的配位化合物为平面四方型结构,试写出Cu2+的d轨道能级排布及电子组态。
6.23 [Ni(CN)4]2-是正方形的反磁性分子,[NiCl4]2-是顺磁性离子(四面体型),试用价键理论或配位场理论解释之。
6.24 Ni(CO)4是个毒性很大的化合物
⑴试根据所学的知识说明其几何构型;
⑵用晶体场理论写出基态的电子理论;
⑶能否观察到d-d跃迁谱线?为什么?
6.25 写出羰基化合物Fe2(CO)6(μ2-CO)3的结构式,说明它是否符合18电子规则。已知端接羰基的红外伸缩振动波数为1850-2125cm-1,而桥式羰基的振动波数为1700-1860cm-1,试解释原因。
6.26 用18电子规则(电子计数法)推测下列分子的几何结构:
(1)V2(CO)12 (2) Cr2(CO)4Cp2 (3) [ Mo6(μ3-Cl)8Cl6]2- (4) [Rh6C(CO)15]2-
6.27 水和乙醚的表面能分别为72.8和17.1×10-7J﹒cm-2, 试解释两者存在如此大差异的原因.
6.28 20°C的邻位和对位硝基苯酚, 在水中与苯中的溶解度之比, 分别为0.39和1.93, 试用氢键说明差异原因.
习题7
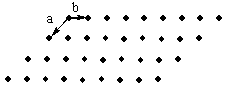
7.1 判断下列点是否组成点阵?
7.2 试从右边图形中选出点阵结构。

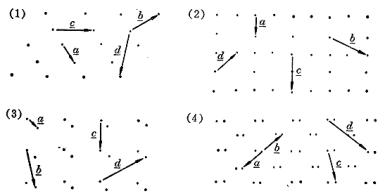
7.3 从下面点阵结构标出晶面指标(100),(210),(1 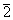 0),(230),(010),每组面用`3条相邻直线表示。
0),(230),(010),每组面用`3条相邻直线表示。
7.4 晶轴截距为(1)2a,2b,c (2)2a,-3b,2c (3)a,b,-c的晶面指标是什么?
7.5 画出一个正交晶胞,并标出(100),(010),(001),(011)和(111)面。
7.6 一立方晶胞边长为432 pm,试求其(111),(211)和(100)晶面间距。
7.7 试证明在正交晶系,晶面间距 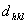 计算公式为
计算公式为 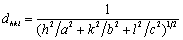 在立方晶系上式简化为:
在立方晶系上式简化为: 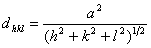
7.8 已知金刚石立方晶胞参数 a = 356.7 pm,写出其中碳原子的分数坐标,并计算C-C键键长和晶体密度。
7.9 为什么14种Bravais格子中有正交底心而无四方底心?
7.10 为什么有立方面心点阵而无四方面心点阵,请加以论述。
7.11 下面所给的是几个正交晶系晶体单位晶胞的情况。画出每种晶体的布拉威格子。
(1)每种晶胞中有两个同种原子,其位置为(0,  ,0);(
,0);( 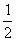 ,0,
,0, 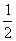 )。
)。
(2)每种晶胞中有4个同种原子,其位置为(0,0, z);(0, 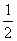 , z);(0,
, z);(0, 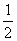 ,
, 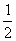 + z);(0,0,
+ z);(0,0, 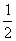 + z)。
+ z)。
(3)每种晶胞中有4个同种原子,其位置为(x,y, z);( 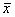 ,
, 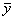 , z);(
, z);( 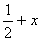 ,
, 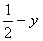 ,
, 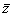 );(
);( 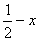 ,
, 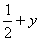 ,
, 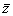 )。
)。
(4)每种晶胞中有两个A原子和两个B原子,A原子位置为( 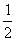 ,0 ,0);(0,
,0 ,0);(0, 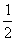 ,
, 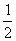 ),B原子位置为(0 ,0,
),B原子位置为(0 ,0, 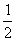 );(
);( 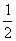 ,
, 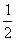 ,0)。
,0)。
7.12 已知CaO为立方晶系,晶胞参数为 a = 480 pm ,晶胞内有4个分子,试求CaO晶体密度。
7.13 金属钨的粉末衍射线指标如下:110,200,211,220,310,222,321,400 ……
(1) 试问钨晶体属于什么点阵形式?
(2) X射线波长为154.4pm, 计算晶胞参数.
7.14 CaS晶体(密度为2.58g/cm3)已由粉末法证明晶体为立方面心点阵,试问以下哪些衍射指标是允许的
(1) 100,110,111,200,210,211,220,222?
(2) 计算晶胞边长。
(3) 若用CuKα辐射(λ= 154.18 pm),计算最小可观测Bragg角。
7.15 四氟化锡(SnF4)晶体属四方晶系(空间群I4/mmm),a = 404 pm,c = 793 pm,晶胞中有2个分子,原子各占据以下位置:Sn (0,0,0; 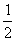 ,
, 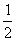 ,
, 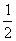 ),F(0,
),F(0, 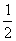 ,0;
,0; 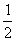 ,0,0;0,0,0.237;0,0,
,0,0;0,0,0.237;0,0, 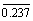 )。
)。
(1)画出晶胞简图;
(2)计算Sn-F最近距离以及Sn的配位数。
7.16 试用结构因子论证:具有面心点阵晶体,衍射指标h、k、l奇偶混杂时,衍射强度为零。
7.17 论证具有体心点阵的晶体,衍射指标 h + k + l = 奇数时,结构振幅 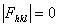 。
。
7.18 硅的晶体结构与金刚石同属A4,用X射线衍射测的晶胞参数a = 543.089 pm密度测定为2.3283 g/cm3,计算Si的原子量。
7.19 在直径为57.3 mm的照相机中,用Cu靶 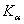 射线拍摄金属铜的粉末图,根据图上得到的八对粉末线的2L值,试计算下表各栏数值,求出晶胞参数,确定晶体的点阵形式。
射线拍摄金属铜的粉末图,根据图上得到的八对粉末线的2L值,试计算下表各栏数值,求出晶胞参数,确定晶体的点阵形式。
|
线号 |
2L/mm |
θ(度) |
Sin2θ |
h*2+k*2+l*2 |
h* k* l* |
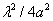 |
|
1
2
3
4
5
6
7
8 |
44.0
51.4
75.4
90.4
95.6
117.4
137.0
145.6 |
|
|
|
|
|
7.20 四硼酸二钠的一种晶型属单斜晶系,晶胞参数:a = 1185.8 pm,b = 1067.4 pm,c = 1219.7 pm, 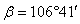 。测得其密度为1.713g/cm3。该晶体是否含水?若含水,其水含数为多少?
。测得其密度为1.713g/cm3。该晶体是否含水?若含水,其水含数为多少?
7.21 用X射线测得某正交硫晶体(S8)晶胞参数为:a = 1048 pm,b = 1292 pm,c = 2455 pm,密度为2.07g/cm3,S的相对原子质量为32.0
(1)计算晶胞中S8分子数目;
(2)计算224衍射线的Bragg角θ。
7.22 核糖核酸酶-S蛋白质晶体,单胞体积为167nm3,胞中分子数为6,密度1.282g/cm3,若蛋白质在晶体中占68%(质量),计算蛋白质相对分子量。
7.23 萘晶体属单斜晶系, 晶胞内有2个分子, 晶胞参数为a:b:c=1.377:1:1.436, β=122°49´,比重1.152, 计算晶胞大小.
习题8
8.1 已知金属 Ni为A1型结构,原子间最近接触距离为249.2pm试计算:
(1)Ni立方晶胞参数;
(2)金属 Ni 的密度(以g× 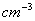 表示);
表示);
(3)画出(100),(110),(111)面上原子的排布方式。
8.2 已知金属钛为六方最密堆积结构,金属钛原子半径为146pm,试计算理想的六方晶胞参数。
8.3 证明A3型六方最密堆积的空间利用率为74.05%。
8.4 计算A2型体心立方密堆积的空间利用率。
8.5. Al为立方晶胞, 晶胞参数a=404.2pm, 用CuKα辐射(λ=154.16pm)观察到以下衍射: 111,200,311,222,400,331,420,333和511
(1) 判断晶胞点阵形式;
(2)计算(110), (200)晶面间距;
(3)计算参照基矢(λ*)的倒易晶格大小。
8.6 金属钽给出的粉末X光衍射线的sin2θ值如下:
|
粉末线序数 |
波长 |
sin2θ |
粉末线序数 |
波长 |
sin2θ |
|
1 |
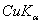 |
0.11265 |
7 |
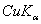 |
0.76312 |
|
2 |
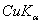 |
0.22238 |
8 |
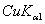 |
0.87054 |
|
3 |
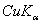 |
0.33155 |
9 |
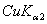 |
0.87563 |
|
4 |
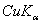 |
0.44018 |
10 |
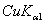 |
0.97826 |
|
5 |
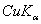 |
0.54825 |
11 |
 |
0.98335 |
|
6 |
 |
0.65649 |
|
|
|
X射线的波长各为
(  )λ = 1.542
)λ = 1.542  ,(
,( 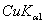 )λ = 1.541
)λ = 1.541  ,(
,( 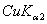 )λ = 1.544
)λ = 1.544  ,试确定的晶系、点阵形式,对上述粉末线进行指标化并求出晶胞参数。
,试确定的晶系、点阵形式,对上述粉末线进行指标化并求出晶胞参数。
8.7 试由结构因子公式证明铜晶体中hkl奇偶混杂的衍射,其结构振幅 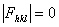 ,hkl全奇或全偶的结构振幅
,hkl全奇或全偶的结构振幅 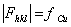 。试问,后一结果是否意味在铜粉末图上出现的诸粉末线强度都一样,为什么?
。试问,后一结果是否意味在铜粉末图上出现的诸粉末线强度都一样,为什么?
8.8 α-Fe为立方晶系,用Cu 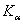 射线(
射线( 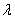 =154.18pm)作粉末衍射,在h k l类型衍射中,h+k+l=奇数的系统消光。衍射线经指标化后,选取222衍射线,
=154.18pm)作粉末衍射,在h k l类型衍射中,h+k+l=奇数的系统消光。衍射线经指标化后,选取222衍射线, 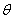 =68.69°,试计算晶胞参数。已知α-Fe的密度为7.87g.cm-3,Fe的相对原子质量为55.85,问a-Fe晶胞中有几个Fe原子。请画出α-Fe晶胞的结构示意图,写出Fe原子的分数坐标。
=68.69°,试计算晶胞参数。已知α-Fe的密度为7.87g.cm-3,Fe的相对原子质量为55.85,问a-Fe晶胞中有几个Fe原子。请画出α-Fe晶胞的结构示意图,写出Fe原子的分数坐标。
8.9 已知Ga属正交晶系,其单位晶胞,a = 4.526 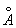 ,b = 4.520
,b = 4.520 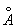 ,c = 7.660
,c = 7.660 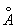 ,分别用以下波长的X光照射:
,分别用以下波长的X光照射: 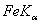 和
和 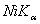 ,
, 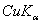 ,求每种情况下大于80°的布拉格角的衍射线指标。
,求每种情况下大于80°的布拉格角的衍射线指标。
8.10 金属钽属于体心立方结构,(231)晶面间距为1.335 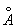 ,求金属钽的密度。
,求金属钽的密度。
8.11 金属锌的晶体结构是略微歪曲的六方密堆积,a = 2.664 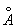 ,c = 4.945
,c = 4.945 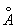 ,每个晶胞含两个原子,坐标为(0,0,0),(
,每个晶胞含两个原子,坐标为(0,0,0),( 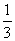 ,
, 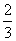 ,
, 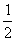 ),求原子。
),求原子。
8.12 金属钠为体心立方结构,a = 429 pm,计算:
(1)Na的原子半径;
(2)属钠的理论密度;
(3)110)面的。
8.13 Ni是心立方金属,晶胞参数a = 352.4 pm,用Cr Kα辐射(λ= 229.1 pm)拍粉末图,列出可能出现的谱线的衍射指标及其衍射角(θ)的数值。
8.14 灰锡为刚石型结构,晶胞中包含8个Sn原子,晶胞参数a = 648.9 pm。
(1)写出晶胞中8个Sn原子的分数坐标;
(2)算出Sn的原子半径;
(3)灰锡的密度为5.75g·cm-3,求Sn的原子量;
(4)白锡属四方晶系,a = 583.2 pm,c = 318.1 pm,晶胞中含4个Sn原子,通过计算说明由白锡转变为灰锡,体积是膨胀了,还是收缩了?
(5)白锡中Sn-Sn间最短距离为302.2 pm,试对比灰锡数据,估计哪一种锡的配位数高。
8.15 Cu属立方面心晶系, 晶胞边长a=361pm, 若用波长154pm的X射线,
(1) 预测粉末衍射最小3个衍射角
(2) 计算Cu的密度.
8.16 CuSn合金属NiAs型结构,六方晶胞参数a=419.8pm,c=509.6pm ,晶胞中原子的分数坐标为:Cu: 0,0,0; 0,0, 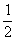 ; Sn:
; Sn: 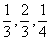 ;
; 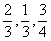 。
。
(1)算Cu-Cu的最短距离;
(2)Sn原子按什么型式堆积?
(3)Cu原子周围的原子围成什么多面体空隙?
8.17 有一黄合金含Cu75% ,Zn25%(质量分数),晶体的密度为8.5 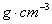 ,晶体属立方面心点阵结构,晶胞中含4个原子,相对原子质量分别为:Cu 63.5 ,Zn 65.4 。
,晶体属立方面心点阵结构,晶胞中含4个原子,相对原子质量分别为:Cu 63.5 ,Zn 65.4 。
(1)求算Cu和Zn所占原子百分数;
(2)每个晶胞中含合金的质量;
(3)晶胞体积多大
(4)统计原子的原子半径多大?
8.18 AuCu无序结构为立方晶系,晶胞参数a = 385 pm [如图左],其有序结构为四方晶系[如图右]。若合金结构由(a)转变为(b)时,晶胞大小看作不变,请回答:
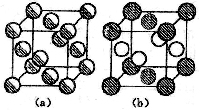 (1)无序结构的点阵型式和结构基元;
(1)无序结构的点阵型式和结构基元;
(2)有序结构的点型式、结构基元和原子分数坐标;
(3)用波长 154 pm的X射线拍粉末图,计算上述两种结构可能在粉末图中出现的衍射线的最小衍射角(θ)数值。
习题9
9-1 CaO、MgO、CaS均是NaCl型晶体。比较它们的晶格能大小,并说明理由。
9-2 述下列常见晶体的点阵形式,晶胞中离子数目与堆砌形式:
(1)NaCl(岩盐) (2)立方ZnS(闪锌矿) (3)六方ZnS(纤锌矿)
(4)TiO2红石) (5)CsCl (6)CaF2石)
(7)刚石 (8)石墨 (9)冰
9-3 离子晶体中正离子填在负离子多面体空隙中,请计算在四面体,八面体空隙中正负离子半径比的临界值。
9-4 已知下列离子半径:Ca2+(99pm)Cs+182pm)S2—184pm) Br—195pm)立方晶系CaS和CsBr晶体是典型离子晶体,请判断这两种晶体正负离子配位数,负离子堆砌方式,正离子所填的配位多面体型。
9-5 某金属氧化物属立方晶系,晶体密度为3.581g·cm—3,用X射线衍射(Cu Kα线)测得各衍射角分别为:18.5°,21.5°,31.2°,37.4°,39.4°,47.1°,52.9°,54.9°,根据计算说明:
(1)属氧化物晶体的点阵形式;
(2)算晶胞参数;
(3)算金属离子M的相对原子质量;
(4)正负离子半径比为0.404,试确定离子在晶胞中的分数坐标。
9-6 已知BeO晶体结构属六方ZnS型,而Be2+,O2—离子半径分别为31pm,140pm,试从离子半径比推测BeO晶体的结构型式,并与实际情况比较,说明原因。
9-7 FeSO4单晶属正交晶系,其晶胞参数为a=482pm,b=684pm,c=867pm,试用Te Kα的X射线(λ=45.5pm),计算在(100),(010),(111)面各自的衍射角。
9-8 红石(TiO2为四方晶体,晶胞参数为:a=458pm, c=295pm,原子分数坐标为:
Ti:0, 0, 0; 1/2, 1/2, 1/2;
O:u, u, 0 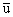 ,
, 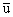 , 0; 1/2+u, 1/2-u, 1/2; 1/2-u, 1/2+u, 1/2;其中u=0.31
, 0; 1/2+u, 1/2-u, 1/2; 1/2-u, 1/2+u, 1/2;其中u=0.31
(1)明Ti,O原子各自的配位情况;
(2)算z值相同的Ti-O最短间距。
9-9 β-SiC为立方晶体,晶胞参数α=435.8pm,晶胞内原子分数坐标如下:
C:0, 0, 0 1/2, 1/2, 0; 1/2, 0, 1/2; 0, 1/2, 1/2;
Si:1/4, 1/4, 1/4; 1/4, 3/4, 3/4; 3/4, 1/4, 3/4; 3/4, 3/4, 1/4;
(1)确定该晶体点型式;
(2)算晶体密度;
(3)算晶体中C-Si键长和Si原子的共价半径(C原子共价半径为77pm)。
9-10 Na2O为反CaF2型结构,晶胞参数α=555pm,
(1)算Na+的半径(已知O2—半径为140pm);
(2)算晶体密度。
9-11 氯化铯晶体属立方晶系,密度为3.97g·cm—3,晶胞参数a=411pm,晶体衍射强度特点是:h+k+l为偶数时强度很大,而h+k+l为奇数时强度很小,根据CsCl结构用结构因子分析以上现象。
9-12 用粉末法可测定KBr,LiBr,KF,LiF均属NaCl型结构,晶胞参数分别为658pm,550pm,534pm,402pm,试由这些数据推出Br—K+F—Li+的离子半径。
9-13 请根据六方ZnS和NiAs晶体的结构图,写出晶胞中各离子的原子分数坐标。
9-14 某个三元晶体属立方晶系,晶胞顶点位置为A元素占据,棱心位置为B元素占据,体心位置为C元素占据,
(1)写出此晶体的化学组成;
(2)写出晶胞中原子分数坐标;
(3)A原子与C原子周围各有几个B原子配位。
9-15 已知KIO3为立方晶系,a=446pm,原子分数坐标为:
K(0, 0, 0I(1/2, 1/2, 1/2),O(0, 1/2, 1/2)(1/2, 0, 1/2)(1/2, 1/2, 0)
(1)晶体属何种点型式;
(2)算I-O,KO最近距离;
(3)画出(100(110),(111)晶面上原子的排布;
(4)检验晶体是否符合电价规则,判断该晶体中是否存在分离的络离子基团。
9-16 冰的某种晶型为六方晶系,晶胞参数a=452.27pm,c=736.71pm,晶胞含4个分子,其中氧原子的原子分数坐标为:0, 0, 0;0, 0, 3/8;2/3, 1/3, 1/2;2/3, 1/3, 5/8。
(1)画出冰的晶胞示意图;
(2)算冰的密度;
(3)算氢键O-H…O长度。
9-17 氟化钾晶体属立方晶系,用Mo Kα线(λ=70.8pm)拍摄衍射图(相机半径为57.4mm),各衍射线sin2θ值如下:0.0132,0.0256,0.0391,0.0514,0.0644,0.0769,0.102,0.115,0.127,0.139……
(1)先对各条衍射线指标化,然后推测KF的点阵形式,计算晶胞参数;
(2)已知KF晶体中,负离子作立方最密堆砌,正离子填在八面体空隙,K+F—离子半径分别为133和136pm,计算晶胞参数;
9-18 高温超导晶体YBa2Cu4O8属正交晶系,空间群为Ammn,晶胞参数为a=b=390pm,c=2720pm,晶胞中原子分数坐标为:
Y: 1/2, 1/2, 0; Ba:1/2, 1/2, 0.13;
Cu:0, 0, 0.21; 0, 0, 0.06;
O: 0, 1/2, 0.05; 1/2, 0, 0.05; 0, 1/2, 0.22; 0, 0, 0.15;
试画出晶胞的示意图。
9-19 某尖晶石组成为:Al 37.9%,Mg 17.1%,O 45%,密度为3.57g·cm—3,立方晶胞参数为a=809pm,求晶胞中各种原子的式量数。
9-20 MgO和NaF是等电子分子,并与NaCl为同样的晶体结构。试解释MgO晶体硬度是NaF晶体的2倍,熔点也高很多(前者2800℃,后者993℃)。
9-21 C60和碱金属形成的K3C60晶体具有超导性。试问在C60形式的立方面心堆砌中,K占据哪些多面体空隙,百分数为多少?请写出K在晶胞中的原子分数坐标。
9-22 尖晶石化学组成为AB2O4氧离子作立方最密堆积,当金属离子A占据四面体空隙时,称正常尖晶石,而A占据八面体空隙时,称反式尖晶石,试用配位场稳定化能预测NiAl2O4是何种尖晶石。
9-23 绿柱石[ Be3Al2(SiO3)6]属六方晶系,空间群为本P6/mcc
(1) [(SiO3)6]12- 基团由6个共享顶点的SiO4四面体组成, 它们排列成一个环, 对称性为6/m, 画出它的结构.
(2) 讨论Be, Al 可能的配位模式.
9-24 二氟化XeF2晶体结构已由中子衍射测定.晶体属四方晶系产品a=431.5pm, c=699pm, 空间群为I4/mmm, 晶胞中有2个分子, 原子分数坐标为
Xe: 0,0,0; 1/2,1/2,1/2;
F : 0,0,z; 0,0,-z; 1/2,1/2,1/2+z; 1/2,1/2,1/2-z
(1)给出系统消光条件;
(2) 画出晶胞简图;
(3) 假定Xe-F键长200pm, 计算非键F–F, Xe–F 最短距离。





