|
§6.3 配位场理论(Ligand field theory)
早在五十年代,就有人用晶体场理论讨论配位化合物的分子轨道的能级分裂,晶体场理论是静电作用模型,把中心离子M与配体L相互作用,看作类似离子晶体中正负离子的静电作用。中心离子d轨道受配体的作用,用微扰理论处理,可计算d轨道分裂能大小。晶体场理论成功地解释了一些配合物的结构与性质,但由于模型过于简单,无法解释不同配体影响分裂能大小的变化次序。以后又有人用分子轨道理论来讨论配合物的能级分裂。
配位场理论是在晶体场理论基础上,用分子轨道理论讨论配位化合物,并结合群论方法,根据配合物的对称性,使计算得到很大的简化。以下简要介绍配位场理论。
配位场理论认为,配合物中心离子的d轨道能级分裂由两个因素决定,一是d电子间的相互作用,另一是周围配体对中心离子的作用。根据光谱测定,配体强弱按以下次序:
CO、CN-
> NO - 2 > NH3 > H2O > F-
> OH- >Cl- > Br-
从上节课配合物中化学键的讨论可看出,配体若与中心离子可形成σ—π授受键即为强配体,若只与中心离子形成σ键的则是较弱的配体。当配体对中心离子的作用大于中心离子本身价电子的相互作用时,此配位场称为强场。而中心离子价电子间作用大于配体作用时,则称为弱场。
一.中心离子电子组态的谱项
在原子光谱项中,我们已介绍,原子或离子价电子的相互作用会导致能级分裂,此现象可在光谱中观察到不同的光谱项。
配合物中心离子主要是过渡金属,在此我们主要讨论dn电子组态的能级分裂。由于“空穴”效应,d1与d9,d2与d8,d3与d7,d4与d6的能级分裂都是相同的,所以只要讨论5种电子组态的能级分裂。
(1).d1(d9):一个d电子填在五个d轨道上,并有自旋向上向下两种选择,则有十种可能状态,根据
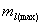 =2, =2,
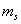 =1/2
=1/2
光谱项为2D
(2).d2(d8):2个d电子的10种可能选择产生
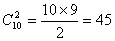 种微观状态,
种微观状态, 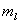 最大值可以取4,对应的
最大值可以取4,对应的
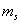 =0,即光谱项1G(包括9个状态:
=0,即光谱项1G(包括9个状态:
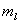 =4,3,2,1,0,-1,-2,-3,-4,
=4,3,2,1,0,-1,-2,-3,-4,
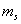 =0)
=0)
2个d电子
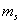 最大值可以取为1,对应
最大值可以取为1,对应
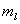 最大值可取3,即光谱项为3F(包括21个状态,
最大值可取3,即光谱项为3F(包括21个状态,
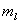 =3,2,1,0,-1,-2,-3,
=3,2,1,0,-1,-2,-3,
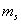 =1,0,-1)
=1,0,-1)
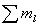 取1, 取1,
 取1的状态不只1个(
取1的状态不只1个(
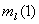 =1,
=1, 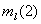 =0,
=0, 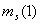 =1/2,
=1/2,
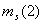 =1/2;
=1/2;
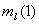 =2,
=2, 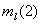 =-1,
=-1, 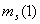 =1/2,
=1/2,
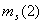 =1/2)因此光谱项还可能有3P(9个状态),剩余的6个状态只能是1D和1S。
=1/2)因此光谱项还可能有3P(9个状态),剩余的6个状态只能是1D和1S。
d2组态可分裂为1G,3F,3P,1D,1S等5个光谱项,根据量子化学计算可知,光谱项按能级从低到高排列为3F,1D,3P,1G,1S
(3).d3(d7):d3电子组态对应120种微观状态(
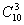 =120)。光谱项为:
=120)。光谱项为:
2H,2G,2F,2D,2D,2P,4P,4F
2D谱项出现两次。
(4).d4(d6):d4组态可产生210种微观状态,组成光谱项为:
5D(25)
3P(9) 3D(15) 3F(21)
3G(27) 3H(23) 3P(9)
3F(21) 1S(1) 1D(5)
1F(7) 1G(9) 1I(13)
1S(1) 1D(5) 1G(9)
其中3F、1P、1G、1D、1S均出现2次。
(5).d5:d5组态有252种微观状态,组成光谱项为:
6S,4D,4G,4P,4F,2S,2D,2F,2G,2I,2P,2D,2F,2G,2H,2D。
|