|
二.金属原子半径
如果将金属原子看作刚球,最近邻原子中心间距的一半就是刚球的半径。人们可用某金属晶体点阵参数来推算该金属原子的半径。
由于刚性模型是粗略的近似,在讨论合金的结构时很有用处。但要应用原子半径来分析具体问题时,即使是同一元素,化学键型的不同、配位数的高低都会使原子半径发生变化。例如金属晶体中,镁原子半径为1.60Å,而在离子晶体中,Mg2+的半径只有0.78Å。即键型对元素半径的影响很大。配位数的影响虽然没有这么显著,但也是不能忽略的。Goldschmidt总结了这种实验现象,提出配位数降低时,原子半径收缩的相对值。
表8-1 不同配位数时原子半径的相对值
|
配位数
|
12
|
8
|
6
|
4
|
2
|
1
|
|
原子半径
|
1.00
|
0.97
|
0.96
|
0.88
|
0.81
|
0.72
|
图8-12
表示各种金属的原子半径(Z=12)和价电子数的关系。在每一周期里,开始时随价电子数增加,电子与核之间作用加强,原子半径显著下降,同时熔点上升。当价电子层填至半满,原子半径曲线经历一个极小值。价电子数再增加,每个壳层中出现自旋相反的电子,电子间斥力增加,使原子半径上升,至周期末又一个极大值。
从第二周期至第五周期,随周期数的增加,曲线向上移,即原子半径加大,第六周期情况较特殊:镧系元素的原子半径基本保持不变。当4f壳层填满后,原子半径才下降。
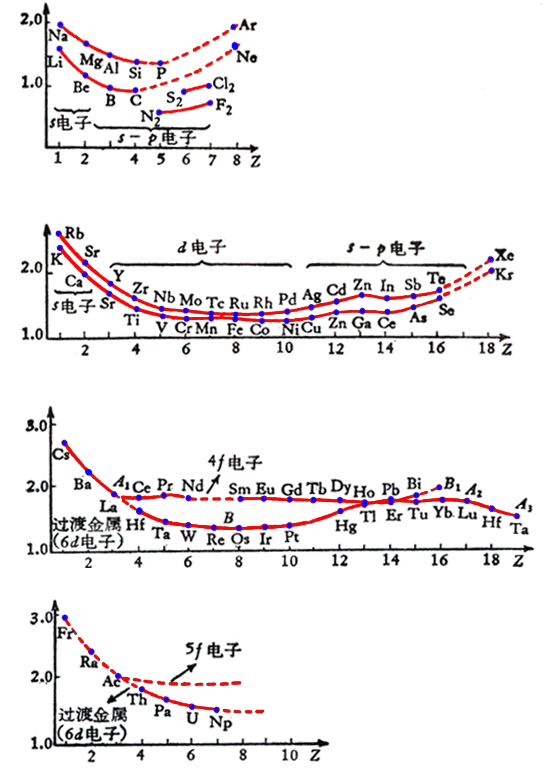
图8-12
|