|
二.金属化合物
当两种金属原子的半径、结构型式差别较大时,则易形成金属化合物。金属化合物的晶体结构往往和单组分不一样,化学键也有差别:电负性差别较大的金属元素之间形成的化合物,两种原子占有确定的结构位置,金属键中含有共价键成分,与一般化合物较相近。
金属化合物因组成不同,结构、性质也相差很大,现举一两种典型结构为例:
1.MgCu2
拉夫斯( Laves)相是金属化合物中的一种典型结构,有三种变形: MgCu2型、 MgZn2型、 MgNi2型。在较常见的 125种 AB2型化合物中有 82种属于 Laves相。
MgCu2型为立方面心点阵,晶胞中有 24个原子, Mg原子作类似金刚石的排列, 4个 Cu原子形成四面体,相互之间共用顶点连接起来,排布在 Mg原子的空隙中,如图所示。
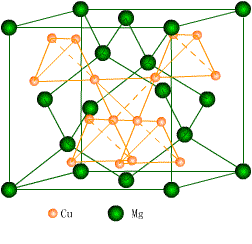
图8-15 MgCu2的晶体结构
若把 MgCu2( 111)面中的 AB两种原子各两层的排列称为 α层,则 MgCu2结构可用 αβγαβγ……层序来表示;如果排列成 αβαβ……则形成立方晶系的 MgZn2结构;如果排列为 αβαγαβαγ……形成立方晶系的 MgNi2结构。
这些 Laves相合金结构也称为拓扑密集结构,形成有两个条件:一是原子尺寸,化合物体积可表示为
V( AxB1-x)= xV( A)+( 1- x) V( B);
另一因素是电子因素,这些以过渡金属为主的化合物中, d能带中电子占据情况(带底为 d电子与 sp电子杂化,带顶有一段空带)起着决定作用。
2.CaCu5
CaCu5合金由图 8- 16中( a)( b)两个原子层交替堆积而成。(
c)是 CaCu 5的晶体结构(图中 3个晶胞体积)。每个晶胞中 Ca位于顶点位置, Cu原子一个位于晶胞中心,两个位于上下底面(
2×2×1/2),两个在四周侧面( 4×1/2)。 Ca原子有 18个 Cu原子配位,同层 6个,上下层各 6个。
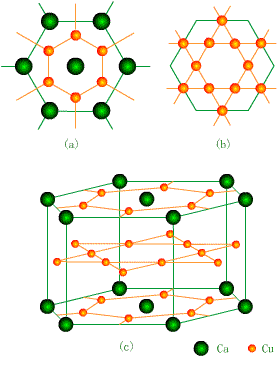
图8-16 CaCu5的结构
储氢合金 LaNi5、 LaCo5、 CeCo5等结构和 CaCu 5相同。 LaNi5是六方晶胞( a= 511pm, c= 397pm),体积为 90×10- 24cm3,储氢后形成 LaNi5H4.5的合金,氢在合金中的密度为:
P=( 4.5/6.02×10 23) ÷90×10 -24= 0.083(g.cm -3 )
比标准状态下的氢气密度( 0.089g.dm -3)约大一千倍。这种能在低压下储氢的方法安全,且储存过程也是纯化氢气的过程。但 LaNi5价格较昂贵,若用混合稀土M( La+ Nd)置换 La,则 MNi5仅是 LaNi5价格的 1/5,且在储氢量和动力学特性方面更优于 LaNi5,具有实用性。
Ti- Mn二元合金中 TiMn1.5储氢性能最好。 Ti- Mn合金为 Laves相结构。
许多金属化合物是功能材料,例如 Ti- Ni合金有很好的形状记忆功能,主要是三种化合物 Ti2Ni、 TiNi、 TiNI3
。
稀土元素和过渡金属 Fe、 Co、 Cu等形成的金属化合物是六十年代开始开发的稀土永磁材料。第一代永磁材料是 RCo5,如 SmCo5具有 CaCu5结构;第二代是 R2TM17( TM为过渡金属),如 SmCo17或 Sm2Cu17, Sm2Zr17;第三代永磁材料是 Nd- Fe- B合金,第四代主要是 R- Fe- C系和 R- Fe- N系列,广泛应用于电机器件等。
|