|
|
|||||||||||||||||||||
|
|
||||||||||||||||||||||
| 当前位置 ->§ 4 双原子分子 -> 4.3 分子轨道理论和双原子结构
-> 4.3.2 双原子分子轨道的特点 |
| 二、双原子分子轨道的特点 两个ns轨道相互重叠,形成一个成键轨道
对于双原子分子轨道,定义一个轨道角动量沿核间轴方向分量的量子数
轨道类型
同核双原子分子(
还可引入一个与原子轨道主量子数相似的标记,用来标明能量增大的顺序,例如(
分子轨道能量取决于两个因素:构成分子轨道的原子轨道类型及这些原子轨道间的重叠,例如,
对于核间距相当小时,
从电子能谱得到验证。
|

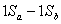 )是1
)是1
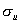 ,(
,(
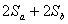 )是2
)是2
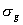 ,(
,(
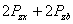 )是2
)是2
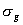 ……对于异核双原子分子,这些轨道简化为1
……对于异核双原子分子,这些轨道简化为1
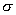 ,2
,2




