|
|
|||||||||||||||||||||
|
|
||||||||||||||||||||||
| 当前位置 ->§ 4 双原子分子 -> 4.3 分子轨道理论和双原子结构
-> 4.3.4 异核双原子分子 |
| 四、异核双原子分子 1.电子组态 不同原子有不同的电子结构,它们不象同核双原子分子可利用相同的原子轨道进行组合。例如LiH分子,Li原子的1s轨道能级低至-75. eV,无法与氢原子的1s轨道(-13.6eV)成键,因此
表4-2 异核双原子分子的电子组态
2.等电子原理 某些异核双原子分子与同核双原子分子电子总数相同,周期表位置相近,它们的分子轨道、成键的电子排布也大致相同,即等电子原理。 例如CO的电子数与N2相同,它们的电子组态也相类似,即它和N2的区别是氧原子比碳原子多提供两个电子,形成一个配键。氧原子的电负性比碳原子的高,但在CO分子中,由于氧原子单方面向碳原子提供电子,抵消了碳、氧之间的由电负性差别引起的极性,所以CO分子
应用等电子原理,BN分子与C2分子相似,电子组态(1σ)2(2σ)2(3σ)2(1π)2,基态光谱项为3Σ 3.轨道能级示意图
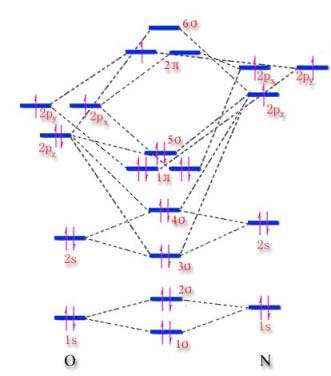
图4-4 NO分子的分子轨道能级图
|
||||||||||||||||||||||||||||||||||||||||||||