|
|
|||||||||||||||||||||
|
|
||||||||||||||||||||||
| 当前位置 ->§ 5 多原子分子一 -> 5.1 杂化轨道理论
-> 5.1.1 杂化轨道 |
|
第五章 多原子分子(一)
Chapter 5. The polyatomic molecules(A)
中心原子在其它原子靠近时,原子轨道能级发生重新排列组合,以利于形成稳定的分子,这一过程称为轨道杂化。例如,C原子基态电子排布为(2s)2(2px)1(2py)1,当4个H原子靠近时,C原子为了与H原子形成4个等价的C-H键,2s,2p轨道发生杂化,形成sp3杂化轨道。轨道杂化前后轨道数目不变,空间排布方向发生变化。常见的杂化轨道有sp,sp2,sp3,和dsp2,d2sp3等,下面分别介绍如何用态迭加原理写出杂化轨道,杂化轨道的方向和轨道杂化后的成键能力。
sp杂化是由一个s轨道与一个p轨道组合而成的两个sp杂化轨道
参于sp2杂化的两个p轨道,设为Px,Py,则sp2杂化轨道可写为
先讨论等性杂化,即在三个杂化轨道中,s轨道都占有1/3成份,即
根据波函数的归一性,可很快写出,
第二杂化轨道
代入数据得:
解出b2=
-
所以
同理可得:
杂化轨道sp、sp2、sp3如图5-1所示,原子经过杂化,可使轨道重叠度增大,成键强度加大。 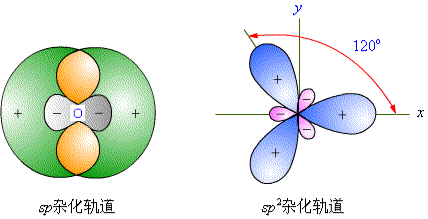
图5-1 杂化轨道
|
||||||