|
|
|||||||||||||||||||||
|
|
||||||||||||||||||||||
| 当前位置 ->§ 5 多原子分子一
-> 5.2 价电子互斥理论 |
|
§5.2 价电子互斥理论
该理论 1940年提出,主要应用于
ABn型分子或离子中。中心原子仅含
s、 p价电子
(或仅含有球对称分布的
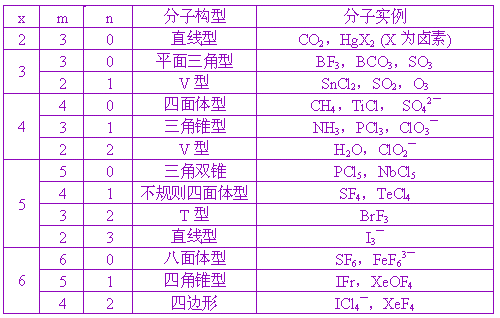
d电子 )。这种分子的几何构型完全由价电子对数来决定。所谓价电子对包括成键电子和孤对电子。 该理论源于价电子对间不仅有静电库仑斥力,还有Pauli斥力。在键长一定的条件下,价电子对相互之间尽量保持较远的距离,该理论虽然简单,但能满意地解释许多化合物的几何构型。 根据立体几何定理可以证明: (1)球面上相距最远的两点是通过球心的直径两端 (2)球面上相距最远的三点是球的内接正三角形的三个顶点 (3)球面上相距最远的四点是球的内接正四面体的四个顶点 (4)球面上相距最远的五点是球的内接三角双锥的五个顶点 (5)球面上相距最远的六点是球的内接八面体的六个顶点 设中心原子 A周围存在 m个配体和 n个孤对电子,两者的和为 x ,则分子结构如表 5-1所示
根据这一规律,预测的 ABn型分子的几何构型与实验结果完全符合。对于含双键或叁键的分子,价电子对互斥理论仍能使用,但双键、叁键都作为一个电子对计算。 在定性推测分子构型时,我们忽略了孤对电子和成键电子,单键与多重键的区别,但在考虑键角等一些问题时,应考虑这些差别。成键电子对受两个原子核的吸引,电子云比较紧缩;孤对电子只受中心原子的吸引 ,电子云比较松散,对邻近的电子对的斥力较大,电子对之间斥力顺序如下: 孤对电子与孤对电子
> 孤对电子与成键电子对 > 成键电子对与成键电子对 重键包含的电子较多,所以斥力顺序如下: 叁键
> 双键 > 单键 例如 CH4 , NH3 , H2O分子中存在键角依次递减的现象。这是因为 CH4中没有孤对电子, ∠HCH恰好为 109°18′ , H2O中有两个孤对电子,它们间夹角较大,使 ∠HOH压缩到 104.5°,而 NH3有一个孤对电子, ∠HNH介于两者之间,为 107.3°。 |
||