1.已知B4H10的结构如图所示,请指出其中缺电子的三中心双电子键。(参考答案)
答:B4H10分子中,B1与B2,B4及H原子分别形成2个
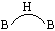 三中心双电子键,B3与B2,B4及H原子也分别形成2个 三中心双电子键,B3与B2,B4及H原子也分别形成2个
 的三中心双电子键,共有4个缺电子键,其余为正常的B-Hσ键。 的三中心双电子键,共有4个缺电子键,其余为正常的B-Hσ键。
2.试用化学键的观点解释配合物中强场低自旋,弱场高自旋现象。(参考答案)
答:配合物中按配体强弱可分为强场,弱场。如CO、CN等配体为强场配体,卤素离子F-、Cl-、Br-、I-为弱场配体。配合物中卤素离子与金属中心原子只形成σ键,配位场分裂能△较小,(小于电子成对能P),所以电子选择高自旋填布,在强场配合物中,CO等与中心金属原子除了形成σ键外,还形成π反馈键,使△>P,所以中心原子价电子选择低自旋填布。同时中心离子价态对△值也有影响,价态较高,△值较大,也使电子选择低自旋填布。
3.试用配位场理论比较八面体场、四面体场、平面四方形场中金属d轨道能级分布情况。
(参考答案)
|