|
(三).问答题:
1.用晶体场理论解释变色胶变色的原因(变色剂为CoCl2)。(参考答案)
解:Co2+:d7在Cl-形成的配位场中Co2+
d 轨道分裂,电子产生 d-d 跃迁,吸收红光而显蓝色,当硅胶吸水后,形成[Co(H2O)6]2+,由于H2O的配位场比Cl-大,Δ(H2O)
> Δ(Cl-),所以d-d 跃迁吸收绿光而显红色。
2.试判断下列配合离子为高自旋构型还是低自旋构型,并写出d电子的排布:
(a)
Fe(H2O) 2+6 (b)Fe(CN) 4-6 (c)Co(NH3)
3+6 (d)Cr(H2O) 2+6 (e)Mn(CN) 4-6(参考答案)
解:
|
Fe(H2O)62+
:d6,Δ < P 高自旋 t 4 2g e *2 g
|
|
Fe(CN)64-
:d6,Δ > P 低自旋 t 6 2g e *0 g
|
|
Co(NH3) 3+6 :d6,Δ
> P 低自旋 t 6 2g e *0 g
|
|
Cr(H2O) 2+6 :d4,Δ
< P 高自旋 t 3 2g e *1 g
|
|
Mn(CN) 4-6
:d5,Δ > P 低自旋 t 5 2g e *0 g
|
3.已知FeF
3-6中d轨道分裂能为167.2kJ,成对能为351.12kJ,配位离子的磁矩为5.9βe,试用分子轨道理论讨论配位离子的电子构型并验证矩值。(参考答案)
解: P
>Δ。;Fe的d5分占t2g和e * g ,FeF 3-6电子组态为
(a1g)2
(t1u)6 (eg)4
(t2g)3 (e*g)2
有5个未成对电子,所以μ= 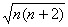 =
= 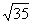 =5.92
=5.92 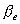
4.在 CuCl2晶体中Cu2+周围有六个Cl-配位,实验测得其中四个Cu-Cl键长为230pm,另外两个键长为295pm,试用配位场理论解释之。(参考答案)
解:在八面体中d轨道分成二组,t2g
:dxz,dyz,dxy;e*g:d
x2- y2 ,d z2
d9电子排布为d
2 xy d 2 yz d 2 xy d 2 z2 d 1 x2-
y2
e*g轨道上电子分布不对称,d
2 z2二个电子与配体斥力大,呈拉长的八面体,所以Cu-Cl键长,d x2-
y2上一个电子与配体的斥力小,Cu-Cl键短。
|
5.血红蛋白是Fe2+的螯合物,其基本骨架如图, Fe2+除与N原子配位外,还结合一分子水, H2O与O2发生输送到体内各部分,当空气中 CO达到一定的浓度时人会窒息死亡,解释其
原因。 (参考答案)
|
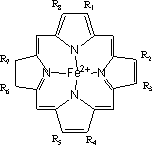 |
解: 当人吸入CO后,CO即进入血液,并代替O2,形成一氧化碳血红蛋白,它要比氧化血红蛋白稳定很多(约140倍),因为在Fe2+与CO之间形成了σ-π反馈键。由于血红蛋白被CO束缚得很牢固,所以它不再起传递氧的作用,而使人死亡。
6.维生素B12对维持机体正常生长,细胞和血红细胞的产生等有极重要的作用。B12的配位部分的示意结构式如下:试说明Co离子与配体成键情况(用什么轨道叠加,形成什么键及电子的提供情况)(参考答案)
解:Co3+
[Ar]d6,d2sp3杂化,周围5个N原子的孤对电子进入杂化空轨道形成5个σ配键,而CN-与Co3+之间形成σ-π键。CN-最高占有轨道5σ提供2个电子与Co3+形成σ键,而Co3+已填充电子的dxy轨道与CN-的反键π轨道形成反馈π键,故CN-与Co3+形成σ-π配键。
7.作图示出[PtCl3(C2H4)]-中Pt2+和C2H4间轨道重迭情况,指出Pt2+和C2H4各用什么轨道成键和电子授受情况,并讨论Pt2+和C2H4形成的化学键对C2H4中C-C键的影响。(参考答案)
解:Pt2+采用dsp2杂化,形成平面正方形配位结构,各杂化轨道分别Cl的p轨道和乙烯的成键π轨道重迭形成σ键,Pt2+的5dxz轨道与乙烯的反键π*轨道对称相同,相互重迭形成π键,电子由Pt的5dxz流向乙烯的π*。乙烯成键轨道上的电子流向Pt,Pt上的电子流入乙烯的π*,这两个效应均导致乙烯的C-C键削弱。
8.
已知[Re2Cl8]2-具有重迭式结构,实验测定的Re-
Re键(224pm)较正常单键为短。试回答下列问题:
(1)分子所属点群
(2)由Re- Re的成键情况说明键长较短的原因
(3)为什么不是交叉式构型? (参考答案)
解: (1)D4h
(2) d
x2- y2 sp2 杂化,形成平面正方形配位;
5 d z2 - 5d z2形成σ键;5dxz
-5dxz,5dyz -5dyz重迭形成二个π键;
5dxy - 5dxy形成δ键;Re-Re为四重键,故较正常单键短。
(3) 如果采用交叉式,则要破坏二个π键和一个δ键,能量上不利。
|