二.晶格能的热力学模型
Bom, Haber, Fajans设计了一个热力学循环,从这一循环实验中,我们也可得到晶格能。同样以 NaCl为例:
| Na(s)= Na(g)
△H升华 (Na) |
|
| Na(g)= Na+ (g)+ e- |
INa |
| 1/2Cl(g)= Cl(g)
|
1/2△H解离(Cl2) |
| Cl(g)+ e-= Cl- (g) |
ECl |
| Na+ (g)+ Cl- (g)= NaCl(s) |
U |
 |
| Na(s)+ 1/2Cl2(g)= NaCl(s)
△Hf(NaCl) |
能量之间关系为 △Hf△H升华+INa+1/2△H解离-ECl+U
通常 △Hf、 △H升华、 INa、 △H解离是已知的,可由此来得到晶格能,例如 NaCl计算得到晶格能为 7.94eV,从热力学循环得到值为 7.86eV,相差 1%。
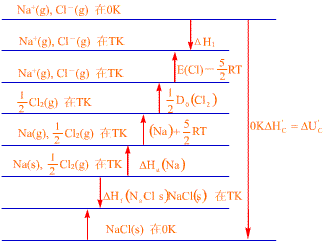
图9-3 NaCl Born-Haber-Fajans热力学循环
|