|
例题与习题
一.例题(1/2)
例一.已知离子半径Ca2+99pm,Cs+182pm,
S2—184pm,Br—195pm,若立方晶系CaS和CsBr晶体均服从离子晶体的结构规则,请判断这两种晶体的正、负离子的配位数、配位多面体型式、负离子的堆积方式、晶体的结构型式。
解:
由已知数据计算出两种晶体的正、负离子的半径比 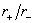 ,根据半径比即可判断正离子的配位数CN+、配位多面体的型式和负离子的堆积方式。由正离子的配位数和晶体的组成即可判断负离子的配位数CN-、(
,根据半径比即可判断正离子的配位数CN+、配位多面体的型式和负离子的堆积方式。由正离子的配位数和晶体的组成即可判断负离子的配位数CN-、(
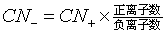 )。根据上述结果和已知的若干简单离子的结构特征即可判断CaS和CsBr的结构型式。结果如下:
)。根据上述结果和已知的若干简单离子的结构特征即可判断CaS和CsBr的结构型式。结果如下:
| |
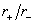
|

|
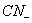
|
配位多面体型式 |
负离子堆积方式 |
结构型式 |
| CaS
|
0.538 |
6 |
6 |
正八面体 |
立方最密堆积 |
NaCl型 |
| CsBr |
0.993
|
8
|
8
|
立方体 |
简单立方堆积 |
CsCl型
|
例二、已知Ag+和I—离子半径分别为115和220pm,若碘化银结构完全遵循离子晶体结构规律,Ag+的配位数为多少?实际上常温下
AgI 结构中,Ag+的配位数是多少?为什么?
解:按题中给出的数据,Ag+和I—的离子半径之比为115pm/220pm=0.523。若AgI的结构完全遵循离子晶体的结构规律,则Ag+的配位数应为6,配位多面体为八面体。但实际上,在室温下AgI晶体中Ag+的配位数为4,配位多面体为四面体。其原因在于离子的极化引起了键型的变异,从而导致了结构形式的改变。
Ag+的半径较小且价层轨道中含有d电子,因而级化能力较强,而I—的半径较大,因而极化率较大即容易被极化,因此,AgI晶体中存在着较大程度的离子间极化,这使得AgI晶体产生了一系列有别于其他AgX晶体的结构效应。
离子的极化作用,导致电子云变形,使正、负离子间在静电作用的基础中啬了额外的相互作用,引起键型变异,就AgX晶体而言,从AgF到AgI,键型由离子键逐渐向共价键过渡,事实上,AgI已经以共价键为主,键能和点阵能增加,键长缩短。AgI晶体中Ag—I键键长为281pm,已经接近Ag和I的共价半径之和286pm
离子的极化不仅影响化学键的性质,而且也影响晶体的结构形式。它往往引起离子的配位数降低,配位多面体偏离对称性较高的正多面体,使晶体从对称性较高的结构型式向对称性较低的结构型式(有时甚至有层型、链型、或岛型)过渡。AgF,
AgCl和AgBr晶体都属于NaCl型,而AgI属于ZnS型 ,在AgI晶体中,Ag+的配位数不是6而是下降为4,配位多面体不是八面体而是四面体。
实际上,本题中给出的数据是配位数为6时的数据。
|