二.离子极化对结构的影响
1.对配位数的影响
离子极化不仅导致离子间的键型从离子键向共价键过渡,离子晶体向共价晶体过渡,然后进一步向分子晶体过渡。同时,离子极化也使正负离子的配位数逐步降低。现以 AB2晶体为例说明。
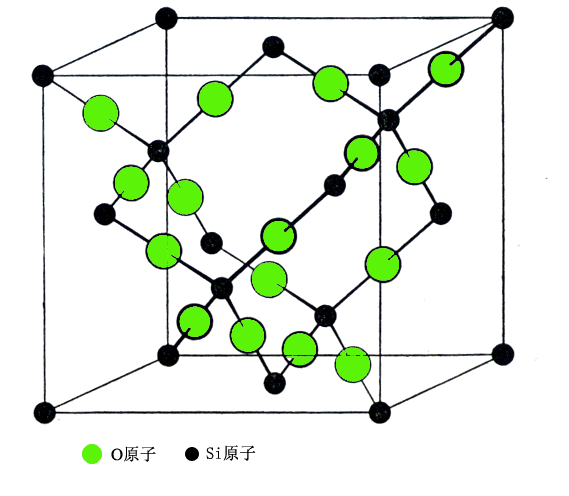
CaF2型晶体是典型的离子晶体,晶体中正负离子配位数比为 8:4,金红石晶体中 Ti4+与 O2-配位数比为 6:3,随着离子极化程度提高,如方石英(立方 SiO2)的构型为 Si,与金刚石结构中 C原子一样,形成 A4堆积; O原子位于 Si-Si连线的中心位置附近,形成三维网络状低密度结构,离子晶体已过渡到共价晶体。晶体中 Si原子与周围 4个氧原子(在四面体顶点方向)成键,氧原子又和 2个 Si原子配位, Si与 O的配位数分别降到 4:2。
 |
 |
|
图9-8 方石英
|
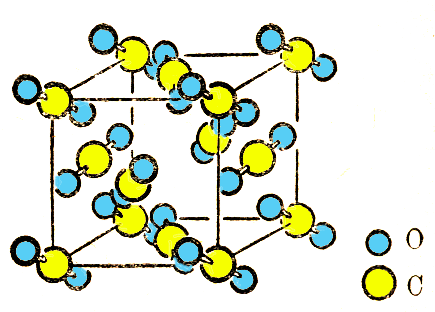
图9-9 CO2(干冰)
|
若离子进一步极化,正负离子配位数下降至 2:1,如 CO2(干冰)晶体,已从共价晶体过渡到分子晶体。在晶体中,一个个直线形 O-C-O分子是分立的, C原子位于立方晶胞的顶点与面心位置,每个 CO2分子轴与平面成一定的角度。 CO2分子中的共价键结合,晶胞中分子间以范德华力联系。卤素、稀有气体元素、 CO2、 SO2等分子和大多数有机物都是分子晶体。
2.结构形式的变异
离子极化使晶体的结构型式从高对称的三维立方构型向层型结构、链型结构、岛型结构转变,这种结构型式的转变在结晶化学中称为型变。
|
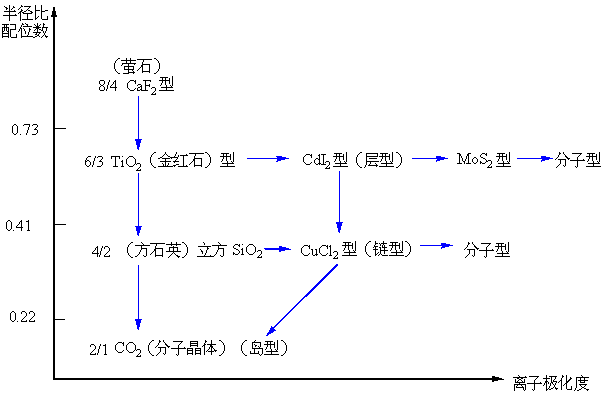
图9-10 AB2化合物晶体的型变
|
金红石晶体是简单四方点阵,晶胞具有 D4h对称性,而 CdI2型晶体则因离子极化成为层型结构。若用 a、 b、 c来代表 Cd的位置,用 A、 B、 C来代表 I的位置,层型分子沿垂直于层的方向堆积,可表示为||AbC||AbC||……(||…||代表一个重复周期)。在 ||AbC||层内每个 Cd有 6个 I-配位,每个 I与 3个 Cd配位,原子间以共价键结合,层与层之间以范德华力结合。层型结构晶体很多,还有 CdCl2型, MoS2型。只是 CdCl2晶体重复周期更长,为 ||AcB|CbA|BaC||
|
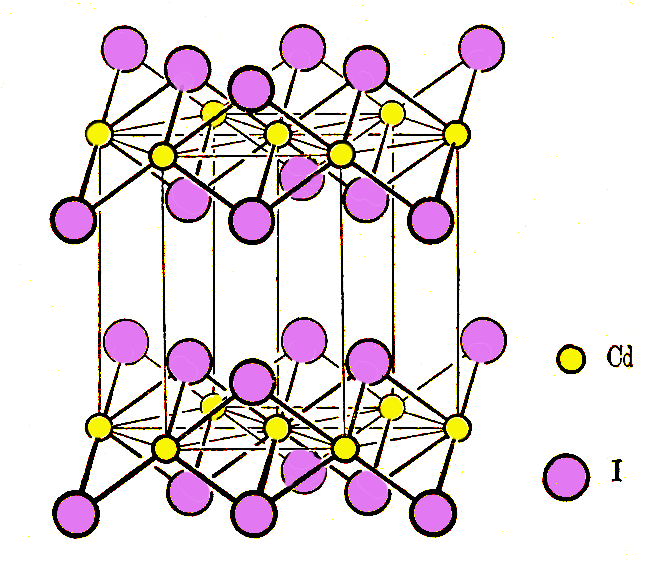
图9-11 CdI2型结构
|
AB2型化合物中,随着正离子半径缩小,极化程度加大,还可形成链型分子,如CuCl2晶体结构中形成(CuCl2)n长链。正负离子配位数比 4:2, CuCl2为单斜晶系。
| 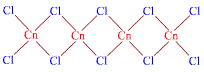
图9-12 CuCl2结构示意图
|
|